硒(Seleniun,Se)是生命活动中必需的微量元素,在人体中以硒蛋白的形式存在,具有提高免疫、抗氧化、抗肿瘤、延缓衰老、解毒和抗辐射等生物与生理功能。人体硒缺乏会降低硒蛋白的表达及生物学功能的正常发挥,会引起如贫血、冠心病、高血压、癌症等40多种疾病,适量补硒有利于人体健康[1-3]。但硒对人体的有益生理功能必需控制在安全浓度范围之内,补硒过量又会引起生物体中毒[4],世界卫生组织(WHO)、联合国粮农组织(FAO)、国际原子能机构(IAEA)均规定了明确指标:膳食硒的供给量为50~250μg•d-t,成人个体硒最高安全摄入量为400g•d-1[5]。人体从环境中摄取硒的主要途径是食物,食物链中硒又主要来源于植物,因此对植物硒的准确测定显得十分重要。

1、实验部分
1.1方法
目前测定硒的方法主要有光学分析法(分光光度法、荧光法、原子荧光光谱法,原子吸收法等)6[6-8]、电化学分析法(阴极溶出伏安法、极谱法等)[9,10]、色谱学分析法(离子色谱法、高效液相色谱法、气相色谱法等)[11]、联用技术(电感耦合等离子体质谱法)等[12,13],每种方法都有其优缺点,在不同的情况下可选择适当的检测方法进行分析。其中氢化物发生-原子荧光光谱法(HG-AFS)因其测定硒具有较高的灵敏度和精确度,所用试剂毒性小,操作简便,实用性强,已入选食品安全国家标准“食品中硒的测定(GB5009.93-2010)”的第一法[14],尤其适合痕量硒的测定,本工作采用氢化物发生-原子荧光光谱法测定植物样品中的硒。
植物硒多以有机形态存在,仪器测定前需转化为无机离子,目前处理植物样品的方法有干灰法和湿法消解等方法,鉴于硒的易挥发特性,植物硒多采用湿法消解。“国标法-食品中硒的测定(GB 5009.93-2010)”采用两种湿消解法:硝酸十高氯酸“电热板”敞开体系常压消解法,硝酸十双氧水“微波”密闭体系消解法。“电热板”消解为传统湿消解法,简便成本低,易操作,但试剂消耗多,温度不能精确控制,消解时多凭经验,消解温度过高或时间过长极易造成硒损失,温度过低有机硒又不能完全被消解,导致测定结果偏低。微波消解是目前被广为推荐的一种微量元素消解方法,程序控温,氧化剂用量少,微波消解时间短且完全,但缺点是微波消解后还需在电热板上赶走残留余酸才能确保测量的准确性。硒的易挥发性决定了硒必须低温赶酸,这一步骤所需时间较长,总体消化过程中只是节省了微波消解部分的时间,且单个样品消化量较少,通常只有0.1~0.5g。本法采用程序控温的石墨消解仪消解处理植物硒,单个样品消化量可达10.0g以上,可以满足痕量样品的大称样量的分析要求。石墨消解虽属于敞开体系,但具有微波消解仪相同的自动控温程序,装有试样的消解管全部包裹于石墨加热孔中,能量不易散失,加热效率高且均匀,消解赶酸能同时进行。且石墨消解管还自带刻度,消解完成后无需转移样液可直接定容,有别于电热板和微波消解的二次转移重新定容过程,避免了在转移过程中的污染和损失。特别是仪器价格比微波消解仪低,经济适用,常规实验室都有能力购买,操作简便安全,所用试剂毒性小,一次可处理大批样品,尤其适合植物样品批量分析,其测定结果令人满意。
1.2仪器与试剂
DS-360智能石墨消解仪;双道原子荧光光谱仪,高性能硒空心阴极灯(北京有色金属研究总院);超纯水机,氩气:纯度为99,99%。
硝酸(HNO3)、高氯酸(HClO)、盐酸(HCl)均为GR。硼氢化钾溶液(10.0g•L-1):称取5.0g氢氧化钾(KOHAR)溶于约500mL纯水中,加入10.0g硼氢化钾(KBH4CP),缓缓摇动使其溶解,定容至1000mL,混匀即可,现配现用。铁氰化钾(100g•L-1)溶液:称取10.0g铁氰化钾(K3Fe(CN)6),AR,溶于100mL纯水中,混匀。植物标样为灌木叶(GBW07602/GSV-1)、柑橘叶(GBW10020/GSB-11)、茶叶(GBW10016/GSB7)、圆白菜(GBW10014/GSB-5),大米(GBW10010/GSB-1)分别购自地球物理地球化学勘査硏究所。
硒标准储备液溶液(100mg•L-1),硒质控环境标准溶液(GSBZ50031-94(203710)),购自中国环境保护部标准样品研究所。试验中纯水为18.3MΩ•cm(25C)超纯水。
1.3样品与测试液的制备
称取2.0g(精确至0.0001g)洗净60C烘干粉碎的植物样,加入10.0mL硝酸十高氯酸(8+2)(g)混酸及几粒玻璃珠于100mL刻度消解管中,上端放弯颈玻璃小漏斗便于回流,混匀放置在石墨消解仪的石墨加热孔中,于通风良好的通风橱内冷消化过夜12h后,石墨消解仪会按预先设定的消解程序进行升温消化,升温程序为:室温→50C保持0.5h100C保持1h-→160C保持2h→-180C保持,最后保持时间视样品消化情况而定。其间要观察消化液颜色,若较深,及时补加硝酸,反复多次,直到没有棕色氮氧化物气体冒出。当溶液变为清亮无色并伴有浓白烟岀现时,继续保持180C加热,其间可加入1~2mL纯水1~2次,目的是赶残余酸,这样可以解决湿法消解测定空白高的特点,直至加热消化到剩余体积为2mL左右时,切不可蒸干,取下冷却至室温,再加入5.0mL50%HCl(g)于剩余消化液中,再次至于消解仪中升温至100C(或沸水浴加热),保持10~15mn,溶液变为清亮无色并伴有白烟时,逐将Se+还原成Se+。取出冷却用纯水定容至25mL,密封摇匀备用。同时做试剂空白。
测试液的制备:按所需稀释比例吸取以上待测液的上清液1.0~5,0mL至10mL比色管中,加入适量的50%HCl(g)(以确保定容后的样液酸度为15%),1.0mL铁氰化钾(10gg•L-1)溶液,纯水定容并混匀。静置30min后上机测试
1.4硒标准溶液配制
将100mg•L-1硒标准储备液用5%HCl溶液稀释至100gg•L标准应用液。从100gg•L硒标准应用液中,分别移取0.00,0.50,1.00,2.00,3.00,4.00,5.00mL至7个50mL容量瓶中,加入少量纯水,再分别向每个容量瓶中加入50%HCl15.0mL(以确保定容后的样液酸度为15%),5.0mL铁氰化钾(100g•L-1)溶液,纯水定容,即可得到一组浓度为0.00,1.00,2.00,4.00,6.00,8.00,10.00gg•L-1系列硒标准工作溶液
2、结果与讨论
2.1原子荧光光谱仪工作参数
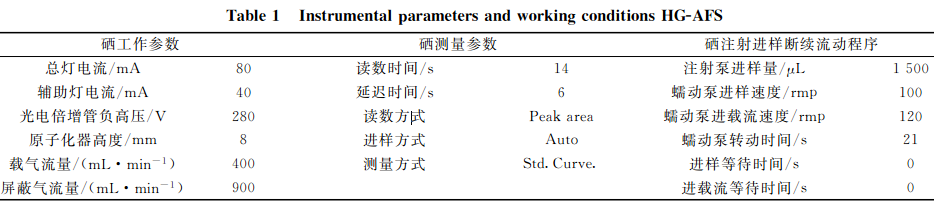
考虑灯电流、光电倍增管负高压、载气流量和反应介质等对分析灵敏度、精确度和准确度的影响,结合AFS-9700型双道原子荧光光谱仪的仪器条件,经反复试验,确定了植物硒测定的最佳工作参数,特别对读数时间和延迟时间进行了反复摸索,最终确定了读数时间为14s,延迟时间必须为6s时,在仪器的信号采集单元内才能获得一个完整正态峰型,此时峰面积最大,达到了最佳积分效果,说明在上述仪器工作条件下,硒荧光强度响应值最高,结果见表1。
2.2消解液用量
准确称取2.0mg(精确至0.0001g)植物标样柑橘叶(GBW10020(GSB-11))样品21份,分3组,每组7次重复。分别加入混酸比为HNO3+HCl0O4(V+V)=(6+4),(8+2)和(9+1)消解液10.0mL及几粒玻璃珠冷消解12h过夜,消解处理制样步骤同1.3,测试硒的相对荧光值,结果见表2。
可知:混酸比为HNO3+HClO(V+V)=8+2处理的柑橘叶样品中硒的相对荧光值最高,且试样重复良好,其余两组荧光值偏低,重复不稳定,特别是混酸比为HNO3+HCIO4(V+V)=6+4一组重复差异较大。说明用HNO3+HCO4(V+V)=8+2混酸比消解处理柑橘叶样品时,硒的提取最完全。
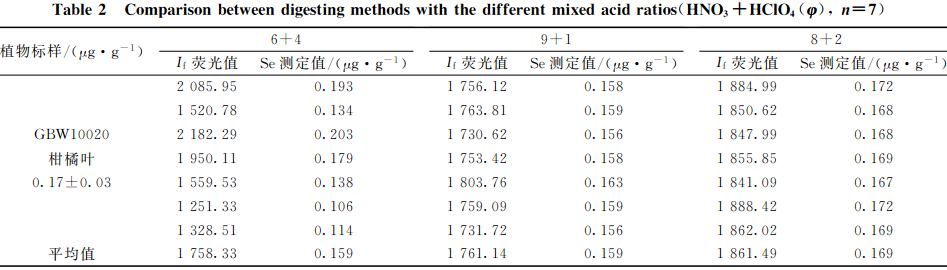
全植物样品中含有大量有机质,在酸量较少的情况下HClO1遇到大量的有机物不仅易发生爆炸,还会造成空白值偏高。实验中加入的HClO41分别为4.0,2.0,1.0mL。发现HClO加入量越多,消化液中HCIO4的残留量就越多。如果消化至剩余体积的2mL左右时,HCO冒烟时间过长,硒有损失,则测定结果偏差较大;HClO44加入量少,消解速度慢,时间过短,消解液颜色深,有机质消解又不完全。对于称样量为2.0g的柑橘叶样品来说,选择混酸比HNO3HClO(V+V)=(8+2)mL,,HClO1加入量为2.0mL,就可以使有机质充分消解。当称样量大时,可以相应增加HClO的量,最终消解液中HClO)残留量约为0.5~1.0mL较为合适。其他实验条件的影响研究均采用(8十2)混酸比来消解植物样品。
2.3消解温度和消解时间的选择
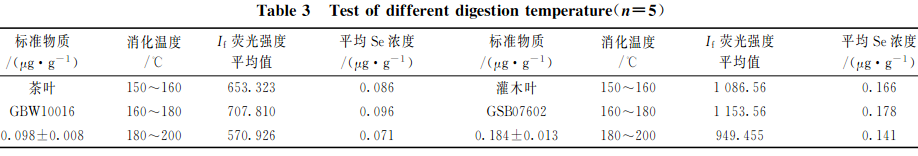
准确称取2.0g(精确至0.0001g)植物标样茶叶(GBW10016)样品和灌木叶(GSB07602)样品各15份,分3组,每组5次重复称样,以2.2中HNO3+HClO4(V+V)(8+2)mL混酸比溶液进行消化处理,再以不同的消解温度进行消化处理,测试硒的相对荧光值,结果见表3。
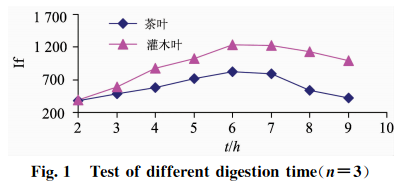
准确称取2.0g(精确至0.0001g)植物标样茶叶(GBW10016)样品和灌木叶(GSB07602)样品各24份,分8组,每组3次重复称样,以2.2中HNO3+HClO4(V+V)(8+2)mL混酸比溶液,以表3中的160~180C为消化温度,分别设定8组消化时间为2,3,4,5,6,7,8,9h,测试硒的相对荧光值,结果见图1。
由表3和图1可知:消化温度控制在160~180C之间消化时间在6~7h之间时,两种植物样品硒的提取最完全;当消化温度<160C,或>180C时,消化时间过短或过长时,硒消化不彻底或容易挥发,都会导致荧光值偏低且不稳定。
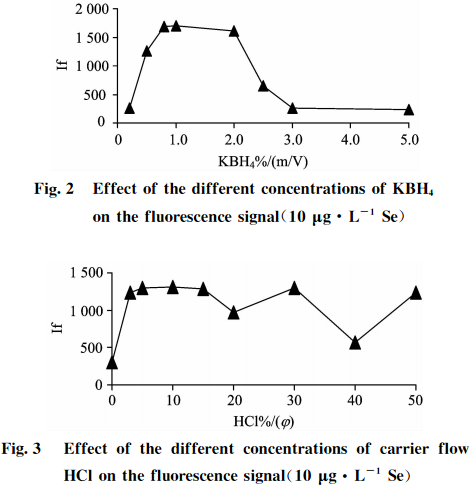
2.4还原剂硼氢化钾(KBH4)和载流盐酸(HCI)的影响
在仪器条件不变的情况下,测试10Hg•L-的Se标准溶液随载流HCl和还原剂KBH4浓度变化对硒荧光强度的影响,结果见图2和图3。可知,当载流HCl和还原剂KBH4浓度低时荧光强度低,信号灵敏度差,说明还原能力弱;当载流HCl和还原剂KBH41浓度增大时,荧光强度也随之增强;当两者浓度太高时,反应产生的氢气多,泡沫都易冲入管道,荧光强度反而会降低,这是由于过量的氢气稀释了火焰中硒原子蒸气造成的。实验结果表明:对于10pg•L1的Se标准溶液,还原剂KBH4浓度在0.8%~2.0%(m/V)之间,载流HC1浓度在4%~15%(g)之间,火焰平稳,荧光值达到最大且稳定,信噪比和灵敏度最高。综合考虑选择还原剂浓度为1.0%KBH4(m/V)+0.5%KOH(m/V),载流HC1为10%(g)。
所配还原剂KBH4溶液要含有一定浓度的KOH以保证溶液的稳定性。建议KOH的浓度为0.2%~0.5%(m/V),浓度过低,KBH4会分解,浓度过高则会影响氧化还原反应的总体酸度,离开KOH和KBH4的浓度来讨论最佳酸度是毫无意义的。
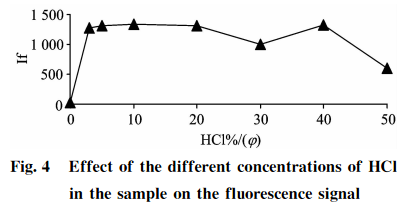
2.5样品酸度(HC的选择样
品消化过程的酸度确保了Se+还原成Se+,上机测试前样品经稀释后制备液酸度也会影响硒的测定结果。分别吸取100gg•L-标准应用液5.0mL于7个50mL的具塞比色管中,分别加入0.0,1.5,2.5,5.0,10.0,15.0,20.025,0mL浓HCl,用纯水稀释定容至刻度,用以制备不同酸度的10gg•L硒标准溶液,以2.4中的最佳载流和还原剂浓度进行上机测定,结果见图4。可知,扣除空白后,HCl(g)在3%~20%范围内,10gg•L-1硒标准溶液具有较强且稳定的荧光强度;当样品HCl(q)>20%时,硒荧光值受到抑制且不稳定,考虑到样品酸度的提高有利于硒的还原,同时可以减少共存元素的干扰,故本方法选用15%HCl(g)酸度作为样品和标准溶液上机测试时制备液的酸度,才能保证测量的稳定性和一致性。
2.6线性方程、检出限
植物样品硒的测定中,标准曲线范围无需很大,本实验在0~10!g•L-的浓度范围内标准曲线线性相关很好,r=0.9999,回归方程y=131.67x+203.94;又对0~100gL-浓度范围进行了测定,其线性相关也很好,r=0.9997,回归方程为y=132.43x+315.13,说明本方法不仅灵敏度高,而且线性范围宽。
在本实验条件下,连续测定空白荧光值11次,并以3倍的标准偏差除以工作曲线的斜率计算出溶液中硒的检岀限0.018g•L-1,若以2.0g植物样品最后定容25mL计算,样品检出限0.225gg•kg-1
2.7标准物质分析及回收率和精密度
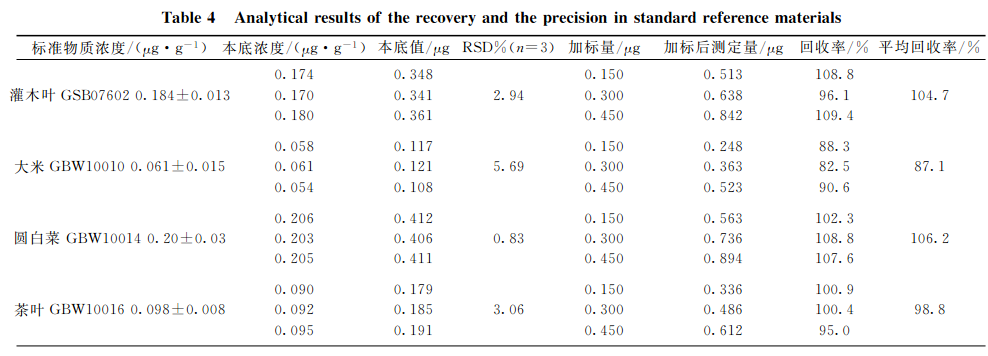
分别选取灌木叶、大米、圆白菜、茶叶和柑橘叶五种植物标准样品,每种重复3次准确称取2.0g(精确至0.0001g),按上述实验条件进行消解,测定本底值。再对每种植物标样称取子样,每种重复3次准确称取2.0g(精确至0.0001g),此次每种试样中分别加入1.0mg•L-1硒标准溶液150,300,450gL,进行消解并测定加标后值,同时测定硒质控环境标准溶液(GSBZ50031-94(203710)),结果见表4。可见,硒标准加标回收率在87.1%~106.2%之间,精密度(n=3)在0.83%~5.69%之间,所测结果均与标准物质的参考值吻合,完全达到分析要求。

3、结论
采用程序控温石墨炉消解-氢化物荧光光谐法在本文得到的最佳实验条件下测定以柑橘叶、茶叶、灌木叶、圆白菜、大米等为代表的几种植物样品中的硒,线性范围宽、灵敏度高、检出限低、稳定性好的显著特点,尤其适合这类批量植物样品中硒的痕量分析,且该方法操作简便安全,实用性强,仪器成本低,所用试剂毒性小,可作为一般实验室的常规分析方法。
参考文献
[1]FergusonLR,KarunasingheN,ZhuS,etal.MutationResearch/FundamentalandMolecularMechanismsofMutagenesis,2012,733(1-2)
[2]WANGKui(王夔).Traceelementsinlifescience,2ndedition(生命科学中的微量元素,第2版)Beijing:ChinesemetrologyPress(北京:中国计量出版社),1996.650
[3]BAOJian-min,YUXiao-yan,LIUWei,etal(包建民,于晓燕,刘微,等).JournalofInstrumentalAnalysis(分析测试学报),2012,31(7):804
[4]ReideME,StrattonbMS,LillicocAJ,etal.JournalofTraceElementsinMedicineandBiology,2004,18(1):68
[5]MAXiu-jie,ZHANGYUE-an(马秀杰,张跃安).ChinesejournalofPublicHealth(中国公共卫生),2009,25(8):1021[6]FilipeC,MiguelM,CarlosC,etal.JournalofFoodCompositionandAnalysis,2011.24(3):351
[7]WANGShi-cheng,WANGYan-hong,LIUYan-hui,etal(王世成,王颜红,刘艳辉,等).Foodscience(食品科学),2013,34(04):183.
[8]SounderajanS,KumarGK,UdasAC.JournalofHazardousMaterials,2010,175(1-3):666.
[9]ZvonimirS,JaroslavaSvarc-Gajic,NikolaM,etal.FoodChemistry,2005,92(4):771
[10]CHANGYIn-fu(常银甫).PhysicalTestingandChemicalAnalysis(Partb:ChemicalAnalysi)(理化检验化学分册),2010,46(8):970
[11]ZHANGHao,MOHai-zhen,ZHOUQuan-xia,etal(张浩,莫海珍,周全霞,等).Foodscience(食品科学),2010,31(14):211
[12]WANGBing-tao,XIELi-qi,LINYan-kui,etal(王丙涛,谢丽琪,林燕奎,等),ChineseJournalofChromatography(色谱),2011,29(3):223.
[13]HULiang,DO)NGZe-qin,HUANGXIao-han,etal(胡良,董泽琴,黄笑寒,等).ChineseJournalofAnalyticalChemistry(分析化学),2011,39(4):466
[14]2010.ThePeople’sRepublicofChinaNationalStandard(中华人民共和国国家标准)NationalFoodSafetyStsndardDeterminationofseleniuminFoods(食品安全国家标准食品中硒的测定).










 全国服务热线
全国服务热线 扫一扫 微信二维码
扫一扫 微信二维码